ВСЕ, ЧТО ТЫ ХОТЕЛ ЗНАТЬ О ГАЗАХ, НО БОЯЛСЯ СПРОСИТЬ
Введение
Настоящее пособие написано с целью дать общие представления о физике процессов, имеющих отношение к деятельности, связанной с техническими газами, их использованием, хранением, транспортировкой, закачкой в баллоны и т.д.
Пособие не претендует ни на какую полноту и касается (и то - отрывочно) лишь ограниченного круга вопросов, имеющих то или иное отношение к вышеуказанной теме. Предполагается, что человек, изучающий настоящее пособие, учился в школе и хоть что-то из школьного курса помнит. Если это не так - лучше начать свое образование с чтения учебника физики за 5-7 классы.
С целью упрощения изложения опущены некоторые тонкости, которые, хотя и являются существенными с точки зрения чистой науки, в настоящем изложении вызвали бы неоправданные длинноты и отвлечения от основной темы.
1. Краткий курс физических величин и их единиц
В настоящем руководстве будут использоваться следующие физические величины:
| Величина | Ед.измерения | Комментарий |
| длина | сантиметр (см) | без комментариев |
| масса | килограмм (кг) | без комментариев |
| время | секунда (с) | без комментариев |
| объем | кубический сантиметр (см3), литр (л), кубический метр (м3) | Будем пользоваться всеми единицами по потребности. Для особо одаренных - поясняю: 1м3 = 1000л = 1000000см3 1л = 1000см3 |
| температура | градус Цельсия (оC) | Существуют и другие шкалы температур, например шкала Кельвина, что будет обсуждаться в тексте. |
| сила | килограмм-сила (кгс) | Нормальные люди используют единицу "Ньютон" (н), но мы будем пользоваться кгс в силу простой интерпретации этой единицы: 1кгс - это сила, с которой гиря массой 1кг притягивается к Земле. Не путать 1кгс с 1кг! В килограммах измеряется масса. Силы измеряются в килограмм - силах! |
| давление | атмосфера (атм) или кгс⁄см2 | Опять же, нормальные люди пользуются единицей "Паскаль" (па), однако нам удобнее эта единица по тем же причинам что и с силой. 1кгс⁄см2 - есть давление, которое оказывает на стол гиря массой 1кг, при площади основания гири 1 квадратный сантиметр (см2). Кроме того, так удачно совпало, что атмосферное давление при нормальных условиях весьма близко к этой величине (а именно 0,987кгс) и, поэтому, в дальнейшем различий межу 1атм и 1кгс⁄см2 мы делать не будем. Там дальше, на картинках, будет упоминаться "бар", так это просто иностранный синоним нашего "атм" |
| энергия | Джоуль (Дж) | это - отдельная песня, ей будет посвящен целый параграф |
Возможно, потребуется представление и о других величинах и единицах их измерения; тогда они будут вводится по ходу дела прямо в тексте.
2. Об энергии, температуре и тепле
Пустое дело - пытаться объяснить, что такое энергия. Это базовое физическое понятие, через которое объясняют все прочие величины. То есть оно - простое, не сложнее понятия о массе, но только до тех пор, пока не пытаешься построить фразу типа: "энергия - это … " или "масса - это … ". Мы такую фразу и не будем пытаться строить. Понадеемся на те представления, которые удалось получить в школе. Какие-нибудь смутные воспоминания о "кинетической энергии", "потенциальной энергии" и т.д. Важно для нас, что любая энергия - механическая, электрическая, химическая (энергия бензина, например) может быть при помощи соответствующих механизмов превращена в работу. Например, химическая энергия батарейки, соединенной с электродвигателем, может быть использована для перемещения какого-либо тела против силы тяжести или против силы трения. Эта способность запасенной энергии совершать работу и позволяет энергию измерить и, следовательно, выразить ее количественно в единицах энергии, называемых Джоулями (Дж). За 1 Джоуль (1Дж) принимается работа, которая совершается при перемещении тела против усилия в 1кгс на 10 сантиметров, например, работа по подъему гири массой в один килограмм на 10 сантиметров вверх, преодолевая силу тяжести. Почему именно на 10? Да так уж принято. И вообще - это вопрос системы единиц. Мы выбрали такую странную систему единиц, что это число даже не точно 10, а, если быть формалистом, 10,197. Однако такой подход позволяет нам использовать наиболее удобные единицы измерения для разных величин, не загружаясь тонкостями их научной систематики. Поэтому вот так: поднял килограммовую гирьку на 10см - есть один Джоуль, поднял на метр - есть 10 Джоулей. И все.
Для общего развития скажем, что электрический ток силой в 1 Ампер и напряжением в 1 Вольт за одну секунду совершает (будучи использованным для питания электродвигателя) работу ровно в 1 Джоуль. А, например, сжатие газа на 1л против давления в 1кгс требует выполнения работы в размере 100 Джоулей. Для проверки этих фактов желающие могут обратится к любому учебнику физики.
Понятно, что энергию можно расходовать не только на совершение механической работы, но и на нагрев чего-нибудь - например, газов. При этом энергия не исчезает, а переходит во внутреннюю энергию газа, что можно заметить по увеличению температуры последнего. Собственно, температура газа и есть мера средней кинетической энергии его молекул. И ее, как ни странно, можно измерить даже просто рукой - холодно или горячо… На сколько именно изменится температура - зависит от того, сколько передано газу энергии, какова масса нагреваемого газа и что это, собственно, за газ (точнее - какая у него теплоемкость). Значения теплоемкостей для подавляющего количества веществ хорошо известны и указаны в соответствующих справочниках (например, мой любимый справочник Кухлинга).
Формула изменения температуры такова:
где ΔT (читается "дельта тэ") - есть изменение температуры газа, выраженное в градусах Цельсия,
m - масса газа в килограммах,
С (читается "це") - теплоемкость газа, взятая из таблиц,
Q - переданная газу при его нагреве энергия, выраженная в Джоулях.
Для примера рассмотрим случай нагревания азота в стандартном 40-литровом баллоне, заправленном стандартным количеством азота 7,50кг. Для нагрева используется электронагреватель (я, правда, не придумал, как его засунуть в баллон) мощностью 1кВт. Продолжительность нагрева - 5 минут.
Начнем с переданной газу энергии. Мощность какого-либо устройства в 1 Ватт, означает (для тех, кто помнит школьный курс физики), что устройство (в данном случае - электронагреватель) выдает на гора каждую секунду энергию в 1 Джоуль. Таким образом, мощность подогревателя в 1кВт (один киловатт) означает, что газу передается 1000 Джоулей энергии в секунду. Итого, за все время нагрева:
Далее, для азота имеем из справочника С = 0,745кДж ⁄ (кг × °C) или, без использования кратных единиц (типа кило-, мега- и проч.), С = 745Дж ⁄ (кг × °С). Здесь уместно отметить, что если для твердых тел и жидкостей в справочниках приводят просто теплоемкость, то для газов приводят две величины - теплоемкость при постоянном давлении и теплоемкость при постоянном объеме газа, что связано с тем, что газы не имеют собственной формы и объема и ведут себя по-разному, когда им есть куда расширяться (как, например, воздух в комнате) и когда их объем ограничен сосудом (это наш случай - газ в закрытом баллоне). Приведенная здесь теплоемкость есть как раз теплоемкость при постоянном объеме.
Подставляя полученные величины в формулу для изменения температуры, имеем:
Итого изменение температуры составит 23 градуса.
Тот же расчет, проведенный для кислорода с учетом того, что в баллоне его 8,82кг (при 150атм и 0°С), а теплоемкость кислорода при постоянном объеме С = 653Дж ⁄ (кг × °С), даст результат
Все расчеты произведены в том предположении, что теплообмен между газом и стенками баллона отсутствует.
Об энергии поговорили, о температуре поговорили, а вот о тепле не сказали ни слова. Непорядок. Так вот "теплом" называется энергия, связанная с тепловым движением молекул газа. Измеряется тепло, как и всякая энергия, в Джоулях. Таким образом, тепло, переданное газу (или отобранное у него), есть энергия переданная газу извне (или отданная газом окружающему пространству). Когда газ получает энергию (тепло), он нагревается, а когда отдает - остывает.
Последнее, что осталось сказать в этой главе, и, опять же для общего развития, это то, что для нагрева 1л воды на 1°С необходима энергия (и это можно посчитать используя табличное значение теплоемкости воды), равная 4190 Джоулям. Так вот - "за те же деньги", то есть используя эту энергию для питания, положим, электродвигателя, можно поднять груз массой в 100кг на высоту 4,2 метра.
3. Идеальный газ.
О многих газах в условиях, не слишком отличающихся от нормальных (0°C и давлении в 1атм), можно мыслить как о совокупности очень маленьких шариков (молекул), находящихся в постоянном движении и соударяющихся друг с другом и со стенками сосуда, в котором находится данный газ. При этом все газы можно считать абсолютно одинаковыми, так как их молекулы считаются неупругими шариками, не обладающими никакой внутренней структурой; а различаются эти шарики (для разных газов) только массой. Для общего понимания дела скажу, что во всех физических уравнениях принято использовать массу молекул, выраженную в атомных единицах массы, причем за одну атомную единицу принимается вес одного атома водорода (самого легкого из всех веществ).
Обозначается масса, выраженная в этих единицах, греческой буквой μ (читается "мю") и называется атомной массой или, для молекул, молярной массой вещества. Для любого сорта атомов, будь то кислород, железо или ртуть, ее легко найти в таблице Менделеева:
|
Так выглядит типовая клеточка в этой таблице. Здесь: "2" - порядковый номер атома (и он же - число протонов в его ядре, но это так, к слову), "Не" - общепринятое латинское сокращение названия атома, "4,003" - его атомная масса. Что значит "Гелий" - ежу понятно. Важно, что атомная масса (μ), как правило, очень близка к целой, а небольшая добавка (в данном случае 0,003), как правило, связана с наличием в природе разных изотопов одного сорта атомов. Поэтому в практике почти всегда используют целые значения атомных масс, не обращая внимания на сотые и тысячные.
Теперь вопрос - какова молярная масса молекул газа кислорода?
Смотрим в таблицу Менделеева:
|
ну, сколько? 16? Неправильно. Если кто-то помнит что-то из школьного курса химии, то кислород представлен в природе двухатомными молекулами и имеет химическую формулу О2, так что его масса есть 2×16, т.е. 32.
Для углекислоты химическая формула СО2, атомная масса углерода (С) равна 12. Таким образом молярная масса молекулы углекислоты есть 12+16×2=44.
Все эти пространные рассуждения нужны нам только для того, чтобы ввести уравнение состояния идеального газа, которое мы должны понимать как обобщение совокупного опыта человечества. Объяснять здесь, откуда оно взялось и почему именно такое, мы абсолютно не собираемся. Однако, человек, работающий с газами, должен знать его, как "Отче наш… " знает человек истово верующий.
ВОТ ОНО:
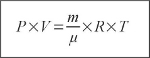
Даже разбуженный ночью, ты должен заплетающимся языком суметь выговорить: "пэ на вэ равно эм делить на мю на эр тэ". А мы теперь попробуем понять, что же означает это магическое заклинание, эта альфа и омега всего газового хозяйства.
Сначала о смысле величин, входящих в это уравнение:
P - давление газа в некотором сосуде, выраженное в принятой нами системе единиц в атмосферах (атм) или, что тоже самое, в кгс.
V - объем этого самого сосуда в литрах.
m - масса газа в килограммах.
μ - молярная масса газа, выраженная в атомных единицах массы (обычно - целое число).
R - универсальная газовая постоянная равная 83,14Дж ⁄ (моль × K).
m - масса газа в килограммах.
Тут, конечно, не обойтись без пояснений.
Первое: почему газовая постоянная выражена именно таким странным кривым числом? Ответ - ни почему. Газовая постоянная есть универсальная мировая константа, такая же как, например, скорость света. Закон природы.
Второе: что такое градусы Кельвина, почему не привычные градусы Цельсия?
Ответ здесь потребует больше времени. Вообще говоря, шкала Кельвина (это, кстати, английский ученый какого-то 17-го, скажем, века, и, между прочим - лорд) не отличается от шкалы Цельсия ничем, кроме того, что за 0°С принята точка замерзания воды, а 0°К соответствуют -273,15°С. А размер самого градуса у них одинаковый. А вот почему -273°С, так это как раз следует из изучения человечеством именно газов.
Еще задолго до появления представлений об атомарном строении веществ, задолго до осознания температуры как средней кинетической энергии молекул газа, было сначала замечено, а затем многократно проверено на всех доступных газах, что для газа замкнутого в неком объеме с понижением температуры на 10°С от, скажем +5°С до -5°С, давление в газе падает на одну и ту же величину независимо от природы газа. Если нанести зависимость давления от температуры для разных газов на график в виде точек, то точки эти всегда выстраиваются в прямую линию, как показано на следующем рисунке:
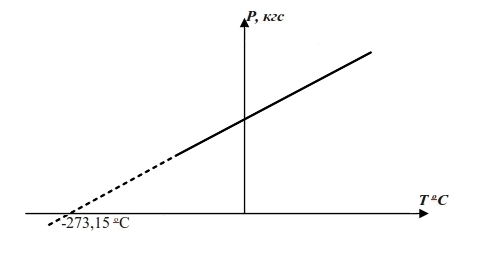
Хотя получать особо низкие температуры тогда не умели, однако сам вид графика заставлял задуматься о том, что дальнейшее понижение температуры должно, в конце концов, привести к тому, что давление газа в некоторый момент вообще станет равным нулю, а по наклону графика можно было вычислить ту температуру, при которой это произойдет, что и было выполнено лордом Кельвином. По сегодняшним уточненным данным эта температура составляет -273,15°С и называется абсолютным нулем температур. Не бывает температур ниже этой, так как при абсолютном нуле полностью прекращается тепловое движение молекул (хоть в газе, хоть в жидкости или твердом теле).
Таким образом, шкала Кельвина - это та же шкала Цельсия, с той только разницей, что отсчет ведется от абсолютного нуля температур и, следовательно, отрицательных температур по Кельвину не бывает. Температуре 0°С соответствует 273°К, 20°С соответствует 293°К и т.п.
Теперь мы можем вернуться к обсуждению практических следствий, вытекающих из уравнения состояния идеального газа.
Следствие 1: при увеличении температуры газа при постоянном объеме давление растет пропорционально росту температуры, так что
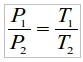
Если, например, давление кислорода в баллоне при 0°С (273°К) составляет 150 атмосфер ровно, то при повышении температуры до 25°С (302°К) давление составит
На практике это означает, что давление в заполненном баллоне существенно зависит от температуры, и в диапазоне температур, реально наблюдаемых в наших краях, скажем, от -30°С до +30°С меняется в довольно широких пределах: от 133атм до 166атм, причем количество кислорода в баллоне остается постоянным (8,82кг). В особых обстоятельствах, например, когда баллон стоит на солнцепеке в жаркий безветренный день, корпус баллона (а, следовательно, и газ в нем) может нагреваться до 80 и более градусов от прямого воздействия солнечных лучей, что может быть опасно для корпуса баллона, опрессованного (испытанного закачкой в него воды под высоким давлением), как известно, на 225 атмосфер. Поэтому, согласно ППБ-77 (правилам пожарной безопасности), места для хранения баллонов в обязательном порядке оборудуются навесом для защиты от солнечных лучей.
Поведение углекислоты при повышении температуры, в целом, описывается теми же соображениями, однако в силу того, что углекислоту в условиях хранения ее в баллонах нельзя, строго говоря, считать идеальным газом, ее поведение мы обсудим в отдельной главе.
Следствие 2: при постоянной температуре давление в газе обратно пропорционально его объему, так что
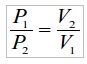
Для примера обсудим азот, находящийся в стандартном 40-литровом баллоне при давлении в 150 атмосфер. Спрашивается, какой объем занимает азот из этого баллона, если его выпустить в комнату, где его давление сравняется с атмосферным и станет, следовательно, равным 1атм? Считаем: раз давление уменьшится, объем, следовательно, увеличится и
Иными словами, за счет высокого давления азота в баллоне в небольшом объеме возможно хранение значительного его количества. Газа, хранящегося в 3-4 баллонах, достаточно, чтобы полностью заполнить средних размеров комнату, а так как азот не имеет ни цвета, ни запаха, то при стравливании баллонов в закрытом помещении человек, это делающий, имеет все шансы задохнуться и не заметить.
Следствие 3: Уравнение состояния можно прямо использовать для расчета давления, объема или массы газа, если известна только часть этих параметров. Например, зададимся целью выяснить массу аргона, находящегося в стандартном 40-литровом баллоне при 150атм.
Непосредственно из уравнения состояния имеем:
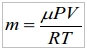
Аргон - одноатомный (в отличии от кислорода, азота, водорода в молекуле которых два атома) газ с атомной массой 40 (химию надо было учить!). Следовательно, μ для него равно 40. Примем температуру воздуха (а, следовательно, и баллона и газа в нем) в момент измерений равной 0°С. Еще раз напоминаю: в уравнении состояния использовать необходимо абсолютную температуру по шкале Кельвина! Тогда:
Истинное количество, равное 10,7кг, несколько отличается от рассчитанного нами, что связанно с тем, что, строго говоря, настоящие газы нельзя в точном значении слова считать идеальными даже в случае классических низкокипящих газов, типа аргона, азота, кислорода и т.п. Однако, ошибка составляет менее полутора процентов, что для практических целей представляется вполне приемлемым.
ВЫВОДЫ
Уравнение состояния идеального газа хорошо (с погрешностью, не превышающей несколько процентов) описывает поведение классических газов в условиях, реально присутствующих в практических приложениях, связанных с техническим применением этих газов (температуры от -50 до +1000°С, давления от 0 до 300 - 400атм). Уравнение является достаточно простым и позволяет предсказывать результаты различных воздействий на газ без проведения широкомасштабных экспериментов, влекущих за собой человеческие жертвы и разрушения. К знанию руководителей газовых хозяйств ОБЯЗАТЕЛЬНО!
Уравнение состояния идеального газа может применяться к:
Аргону (атомная масса 40, одноатомная молекула, μ = 40)
Азоту (атомная масса 14, двухатомная молекула, μ = 28)
Водороду (атомная масса 1, двухатомная молекула, μ = 2)
Воздуху (смесь газов, μ принимать = 29)
Гелию (атомная масса 4, одноатомная молекула, μ = 4)
Неону (атомная масса 20, одноатомная молекула, μ = 20)
Для углекислоты (СО2, μ = 12(углерод) + 16(кислород)× 2 = 44), а также пропана (С3Н8 , μ = 12(углерод)× 3 + 1(водород)× 8 = 44), уравнение может применяться только в условиях далеких от условий ожижения, т.е. в условиях относительно высоких температур и не слишком больших давлений (для углекислоты Т >> -57°С, Р < 10атм, при температуре больше +31 °С при любых давлениях; для пропана Т >> -42°С, Р < 5атм). Поведение углекислоты в условиях близких к условиям ожижения будет рассмотрено в отдельной главе.
Уравнение состояния идеального газа к ацетилену (С2Н2) в баллоне применить невозможно, т.к. ацетилен там находится не в виде свободного газа, а в виде раствора ацетилена в ацетоне и живет по совершенно иным законам. Однако для свободного ацетилена это уравнение хорошо применимо (μ = 12(углерод)× 2 + 1(водород)× 2 = 26).
Последнее, что необходимо добавить в этой главе.
В левой и правой части уравнения состояния идеального газа стоит величина с размерностью энергии (опустим доказательство этого факта, его можно найти в любом учебнике физики). Более того, это энергия, заключенная в газе, и есть! Причем в левой части уравнения она выражена через чисто механические величины (объем и давление), а в правой - через термодинамические (температуру), т.е., в конечном счете, через кинетическую энергию молекул газа, что позволяет, в частности, осознать связь температуры и энергии.
Для вашего понимания серьезности положения проведем расчет энергии, заключенной в 40-литровом баллоне с аргоном (азотом, гелием, кислородом, да все равно…).
Р = 150атм, V = 40л. В главе "Об энергии, температуре и тепле" мы упоминали, что сжатие газа на 1л против давления в 1кгс (1атм) соответствует работе в 100Дж, следовательно, в нашем баллоне с азотом заключена энергия, равная
Этой энергии хватит на то, чтобы закинуть груз массой 100кг (например незадачливого экспериментатора) на высоту 600 метров! Если ты не птица - отнесись к этим цифрам со всей серьезностью. Сжатые газы не шутка!
4. Сжиженные газы и газы вблизи условий ожижения.
Существуют уравнения состояния, описывающие так называемые "реальные газы", то есть, уравнения, учитывающие тот факт, что газы, на самом деле, состоят не из идеальных круглых и абсолютно упругих шариков, а из вполне конкретных молекул, обладающих при определенных условиях некоторым притяжением друг к другу и, в результате, могущих, при достаточно низких температурах и относительно высоких давлениях, переходить в конденсированные состояния (жидкость, твердое тело). Однако универсальность и точность описания, которые обеспечивают эти уравнения, не слишком высока, а сложность самих уравнений выходит далеко за рамки школьного курса. Исходя из этих соображений, приводить их здесь не представляется целесообразным. Поэтому мы ограничимся некоторыми общими соображениями и экспериментальными фактами, не тратя времени на их теоретическое обоснование. И конкретно сосредоточим усилия на практически важном для нас случае сжиженной углекислоты.
Общая идея переходов "твердое тело" "жидкость" "газ" (так называемых "фазовых переходов") для всех, без исключения, веществ (ну, вернее, почти для всех) может быть представлена графически на рисунке, известном как "фазовая диаграмма". Вот он:
Понимать изображенное на этом рисунке надо так: в твердом состоянии (мы кратко будем называть его "лед") вещество может находится лишь при совершенно определенных температурах и давлениях (область "лед" на диаграмме). Пусть вещество находится при некоторой температуре ТА и давлении РА. Тогда на диаграмме эта ситуация может быть отмечена графически точкой (точка А). Если при неизменном давлении увеличивать температуру, можно перевести вещество в другое состояние с температурой и давлением соответственно ТА′ и давлении РА′ (точка А′). Если эти точки находятся в разных областях диаграммы, то можно утверждать, что в процессе нагрева вещество обязательно расплавится и превратится в жидкость, причем произойдет это тогда, когда температура станет равной температуре в точке пересечения линии А-А′ с линией диаграммы, разделяющей области "лед" - "жидкость".
Относительно линии В-В′ ясно: при нагреве жидкость испарится и перейдет в газообразное состояние. Надо ясно понимать, что все газы есть пары своих жидкостей. Так, например, кислород есть пар жидкого кислорода, просто температура его кипения (-183°С) столь низкая, по сравнению с привычными нам, что мы практически никогда не видим его в виде жидкости. Разумеется, возможен и обратный процесс: B′-B. Когда газ (пар) охлаждается он превращается снова в жидкость. Этот процесс называется "конденсация" (капли на крышке кипящего чайника - результат этого процесса, там пар, соприкасаясь с более холодной, чем днище чайника, крышкой, превращается обратно в воду).
Определенный интерес представляет линия С-С′ на диаграмме. Она изображает процесс т.наз. "возгонки", т.е. перехода твердого тела непосредственно в газ, минуя жидкую фазу. Этот процесс весьма характерен для углекислоты. "Сухой лед", т.е. твердая углекислота на воздухе постепенно испаряется и исчезает, но никто еще не видел при этом ни капли жидкой углекислоты. Глядя на диаграмму, легко заметить, что процесс возгонки может идти только при достаточно низких давлениях, а при более высоких - переход из льда в жидкость идет обязательно через промежуточную жидкую фазу.
Легко видеть, что процессы фазовых переходов могут быть вызваны не только изменением температуры, но и, при неизменной температуре, изменением давления, как представлено точками D-D′. Температура остается неизменной, а жидкость, тем не менее, испаряется. На этом, в частности, основан процесс вакуумной сушки, широко применяемый в пищевой промышленности (бульонные кубики "Магги" и прочая дребедень). Этот момент важный. В реальной жизни мы, как правило, находимся в условиях постоянного (атмосферного) давления и, поэтому, подсознательно считаем, что процессы перехода "лед" - "жидкость" - "газ" вызваны только нагреванием (чайник - на огонь, пиво - в морозилку), но, на самом деле, фазовые переходы наблюдаются в результате действия двух факторов - изменения температуры и давления.
Особый интерес представляет точка КТ на фазовой диаграмме. Это - так называемая "критическая точка". Если температура вещества выше, чем соответствующая этой точке "критическая температура", то, независимо от плотности вещества, нет возможности отличить жидкость от газа. Представить себе такое состояние весьма трудно, т.к. в реальной жизни, практически мы не имеем дела с достаточно плотными веществами при температуре выше критической из-за малости атмосферного давления. Однако, в условиях газового баллона при высоком давлении в жаркий летний полдень углекислота как раз находится в таком странном состоянии (критическая температура для углекислоты +31°С). Некоторое интуитивное представление о нем может дать, разве что, турецкая баня, когда влажность такова, что кажется еще немного - и не понять будет, что вокруг: водяной пар или не слишком плотная вода (хотя аналогия эта, конечно не слишком корректна - критическая температура для воды +374°С)
Точка ТТ носит название "тройной точки", в окрестностях которой переходы между состояниями "лед" - "жидкость" - "газ" происходят без заметного изменения температуры и давления. Для общего развития добавим, что точка эта весьма устойчива в экспериментах по температуре, так как пока не расплавится весь лед (а на это требуется некоторая энергия), дальнейшее повышение температуры вещества (например, воды) не происходит, даже если его подогревать. Соответственно за 0°С принимается температура тройной точки воды (а не температура таяния льда при нормальных условиях, как говорится в упрощенных учебниках природоведения) в силу твердой определенности этой точки в координатах давление-температура. Правда, отличается "правильный ноль" от "приблизительного" лишь на доли градуса.
Важно понимать, что фазовые диаграммы вышеуказанного вида характерны для всех вообще веществ, другой вопрос, что конкретный их вид, а также положение тройной и критической точек для разных веществ весьма различаются. Так, для кислорода тройная точка достигается при температуре -219°С, для воды +374°С, а для вольфрама при каких-то температурах далеко за 3000°С.
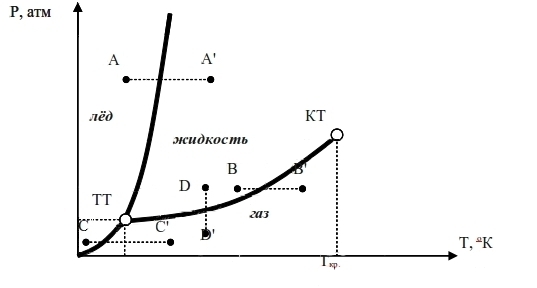
Перейдем теперь к собственно к углекислоте. Надо ясно понимать, что представление о фазовых диаграммах мы ввели тоже несколько упрощенное, однако с углекислотой придется разобраться до тонкостей. С громадным трудом мне удалось-таки добыть ее фазовую диаграмму, причем только из одного источника, который, в свою очередь, ссылается на другой (иностранный) источник, которого я не видел. Короче, достоверность сведений на этой диаграмме проблематична, однако, приблизительно (на ощущения) она все-таки чему-то соответствует, кроме того, другой все равно нет. Хуже того: так как она досталась мне практически безо всякого описания, я и сам не могу объяснить всех особенностей поведения углекислоты, на ней присутствующих. Поэтому, по меньшей мере половину из дальнейших рассуждений следует начинать словами: "Как я понял из отрывочных сведений …" или: "Сколько я могу догадаться …", однако для краткости изложения мы все эти периоды и красивости опустим.
Итак фазовая диаграмма углекислоты:
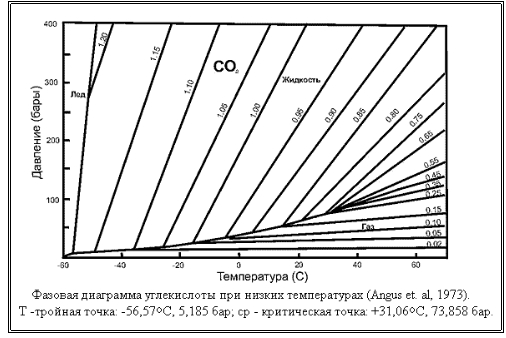
На диаграмме легко увидеть знакомые черты фазовых диаграмм вообще: тройную точку, критическую точку, линии, разделяющие области, где может существовать лед, жидкость, газ. На следующем рисунке я их выделил черным цветом.
Собственно это и есть фазовая диаграмма. Линии, оставшиеся серыми, представляют поведение реальной системы "жидкая углекислота" + "газообразная углекислота" при различных значениях плотности системы. Они просто наложены на ту же фазовую диаграмму для удобной привязки к ней. Причем под плотностью следует понимать усредненную плотность системы в пределах сосуда, ее содержащего. Иными словами, если в сосуде емкостью один литр при некоторых условиях содержится 0,6 кг жидкой углекислоты и 0,4кг газообразной, усредненную плотность газовой системы следует принимать равной сумме масс обоих фаз, деленную на совокупно занимаемый ими объем. В нашем случае это (0,6кг + 0,4кг)⁄1л = 1кг ⁄ л.
Легко объяснимо поведение системы для небольших значений плотности. Для примера возьмем линию, отвечающую на диаграмме плотности в 0,15кг ⁄л, что соответствует заправке в стандартный 40-литровый баллон 6 килограммов углекислоты (6кг ⁄ 40л = 0,15).
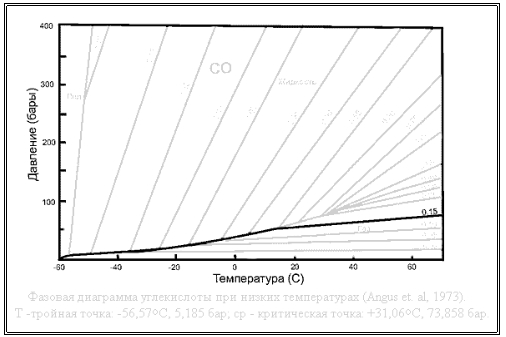
При низких температурах (-40°С и ниже) почти вся углекислота представлена жидкостью, находящейся на дне сосуда, над которой имеется незначительное количество не очень плотных паров углекислоты. С повышением температуры начнется более интенсивное испарение углекислоты с поверхности жидкости, однако прирост давления будет не очень значительным, ибо если в какой-то момент испарится чуть больше жидкости, чем нужно, давление в баллоне повысится, система перейдет в область диаграммы "жидкость" и, следовательно, начнется активный процесс конденсации газообразной углекислоты (т.е. превращения ее обратно в жидкость). Таким образом, вплоть до температуры в +14°С траектория системы (т.е. линия, образованная из точек ее состояния, снятых для разных температур) будет повторять границу раздела жидкость-газ на фазовой диаграмме. Чуть больше испарилось - увеличивается конденсация, чуть больше сконденсировалось - увеличилось испарение. В этом случае говорят, что газожидкостная система находится в термодинамическом равновесии (на границе двух своих сред - жидкости и газа). Далее, к моменту достижения +14°С и более, вся жидкость, имевшаяся в баллоне, испарится, траектория системы оторвется от линии раздела жидкость-газ и в дальнейшем (при еще большем нагревании) будет подчиняться обычным законам изменения давления газа с ростом температуры (имеется ввиду уравнение состояния идеального газа), т.е. будет линейно расти. Именно этот рост давления мы и наблюдаем в правой части графика (правее +14°С).
Сложнее обстоит дело для высоких значений средней плотности. Пусть теперь средняя плотность газожидкостной системы равна 1кг ⁄л, что соответствует заправке в стандартный 40-литровый баллон 40кг углекислоты. В этом случае даже при низких температурах количество углекислоты в баллоне в жидком состоянии весьма велико, а газовая фаза представлена незначительной областью в самой верхней части баллона. В этом случае при повышении температуры углекислоты траектория системы также следует кривой раздела между жидкостью и газом на диаграмме состояния с поддержанием термодинамического равновесия между жидкостью и газом. Однако из-за существенного коэффициента объемного расширения углекислоты (точное значение мне в литературе найти не удалось) жидкая фаза с ростом температуры быстро увеличивается в объеме, занимая свободное пространство в котором раньше располагалась газовая фаза. Уместно напомнить, что все тела при нагревании расширяются по закону вида: L = L0× (1 + α × ΔT), где L0 - начальная длина тела, L - длина после нагревания, ΔT - изменение температуры, α - коэффициент линейного расширения. Для жидкостей та же зависимость выглядит следующим образом: V = V0× (1 + β × ΔT), где V0 - начальная объем жидкости, V - объем после нагревания, ΔT - изменение температуры, β - коэффициент объемного расширения. Соответственно, в момент, когда расширившаяся жидкость заполнит весь объем баллона, произойдет отрыв траектории системы от линии раздела фаз на фазовой диаграмме, после чего давление в баллоне будет определяться объемным расширением жидкости при нагреве, а это очень мощный, в смысле возникающих при этом давлений, процесс. Соответственно, траектория такой системы будет выглядеть в координатах темперпатура-давление так:
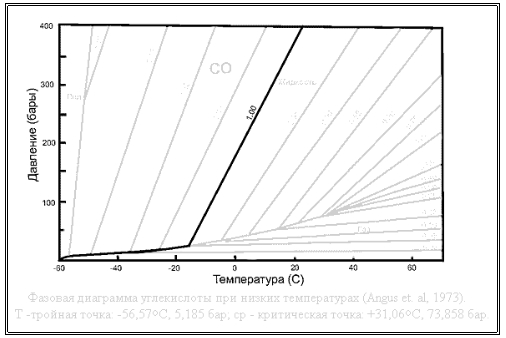
Здесь, вплоть до температуры в -17°С, траектория системы следует линии раздела фаз, после чего отрывается от нее и круто поднимается вверх, достигая к 15-20°С давлений в области 300-400 атмосфер.
ВЫВОДЫ:
Поведение газожидкостной системы в баллоне прямо зависит от средней плотности углекислоты в нем или, иными словами, от того, сколько туда закачано углекислоты. Причем, в случае, когда средняя плотность ниже некоторой критической плотности, события развиваются по первому ("мягкому") варианту, а если выше - по второму ("жесткому"). Исходя из имеющейся фазовой диаграммы (и если ей верить), можно утверждать, что для углекислоты эта критическая плотность составляет что-то около 0,55 - 0,60кг ⁄л. Соответственно, предельные количества заправки углекислоты для баллонов разной емкости составляют:
5-литровый баллон ≤ 3кг углекислоты (5л × 0,6кг ⁄л)
10-литровый баллон ≤ 6кг углекислоты (10л × 0,6кг ⁄л)
40-литровый баллон ≤ 24кг углекислоты (40л × 0,6кг ⁄л)
Это - предельные нормы. Превышение этих количеств (по любым причинам, будь то раздолбайство персонала или неисправность весов) влечет за собой весьма неприятные последствия в виде разрыва баллона, для которого опрессовкой гарантируется исправная работа при давлении до 225атм (для углекислотных даже меньше - 150атм), а натурные испытания регулярно показывают разрушение даже абсолютно нового баллона при давлении 350-400атм. Чем это чревато, мы уже убедились в параграфе "Идеальный газ".
КОЛЛИЧЕСТВАХ НЕ ВЫШЕ ПРЕДЕЛЬНЫХ ДЛЯ ДАННОГО ВИДА БАЛЛОНОВ !!!
РАЗБОР ПОЛЕТОВ:
Отчего же на нашем предприятии зимой 2002 взорвались два 5-литровых баллона? Почему этого не происходило раньше? Будет ли это происходить в дальнейшем?
На первый вопрос ответ простой:
1) Плохо была отлажена система отсечки (автоматического прекращения закачки) для маленьких (5- и 10-литровых) баллонов из-за недостатков в конструкции электроники весов.
2) До аппаратчиков не были доведены все последствия закачки углекислоты в баллоны сверх нормативов.
3) Работы производились в ночную смену, когда внимание ослаблено, так что если бы они и знали все, толку от этого было бы мало, не говоря уже про то, что я здорово подозреваю, что они по случаю ночного времени, сильного мороза и отсутствия должного контроля, могли быть изрядно выпивши.
Второй вопрос сложнее. Полагаю так:
Чтобы понять, почему раньше не происходило взрывов баллонов, надо знать, как устроена система отсечки на углекислотной станции. Она имеет два контура. Первый - отсечка по массе заполненной углекислоты, обеспеченная специально сконструированным для нас электронным устройством, присоединенным к весам, неплохо функционирующему, на работу с маленькими баллонами однако не рассчитанным. Второй - отсечка по давлению в линии, обеспеченная электроконтактным манометром (ЭКМ), настроенным на отключение насоса при повышении давления более 40-50атм. Теперь надо иметь виду, что обычно закачка баллонов велась при не слишком низких температурах, что-нибудь в районе -10… -15 градусов минимум. Если обратиться к фазовой диаграмме углекислоты, видно, что закачка в этих условиях до средних плотностей, превышающих 0,85, невозможна (даже при несработке отсечки по массе и ошибках персонала) - сработает отсечка по давлению, а она на моей памяти еще ни разу не подводила. Реально, средняя плотность была даже еще ниже - порядка 0,7-0,75, так как закачка идет импульсами (толчками) и стрелка манометра постоянно дрожит, а срабатывает он при первом же касании стрелкой контакта. Таким образом, если нарушения и были (а они, таки, наверное были!), реальный коэффициент заполнения не превышал, видимо, 0,75кг ⁄л. При этом даже при последующем нагреве баллона до 20-25°С давление в нем (сообразно той же фазовой диаграмме) не поднималось выше 130-150 атмосфер, что для баллона не опасно. Однако, можно ожидать, что той зимней ночью (а были вообще порядочные морозы), температура могла быть в районе -20 (а то и -25…-30) °С. Из фазовой диаграммы видно, что в районе этих температур траектории газожидкостных систем весьма пологи, давление в баллоне слабо зависит от коэффициента заполнения и, следовательно, даже при температуре -20°С отсечка по давлению сработает только при достижении средней плотности в районе 1,0кг⁄л, а при понижении температуры еще на пару градусов можно получить и 1,05 и даже 1,10. Неудивительно, таким образом, что когда на утро температура поднялась до -10°С в баллонах возникло давление на уровне 300 - 400атм (см. опять же фазовую диаграмму).
Третий вопрос:
Нет никаких сомнений, что если некоторые раздолбаи не отладят работу отсечки по массе для ВСЕХ типов баллонов до надежности швейцарских часов, не заинструктируют и не замордуют аппаратчиков до слез, то каждую зиму в начале оттепели, после того, как пару дней постоит мороз в -20… -30 градусов, эти раздолбаи будут гибнуть через одного. Или, как вариант, будут садится на тюремные нары, если накачанные в мороз баллоны будут отгружены клиентам. Не говорите потом, что я вас не предупреждал. Я с вами сидеть не хочу! И своими руками обезвреживать такие баллоны путем высверливания отверстия в вентиле - тоже!
Руководителю газового хозяйства, если он не дурак, не самоубийца и не любитель тюремной пищи, крайне рекомендуется периодически выборочно проверять заполненные его аппаратчиками баллоны на предмет соответствия массы закачанной в них углекислоты нормам. Занимает это ровно две минуты - для нескольких баллонов из партии производится контрольное взвешивание, после чего из полученных цифр вычитаются выбитый на каждом баллоне вес оболочки (ну плюс, скажем, грамм четыреста - вес вентиля). Если отклонение от нормы составляет более 15-20% - соответствующему аппаратчику выдается подарок. Эта операция, кстати, очень благотворно сказывается на качестве заправки, расходе углекислоты и объеме рекламаций клиентов.
5. К вопросу о баллонах и магистралях
Еще несколько слов хотелось бы сказать о разного рода таре для хранения сжатых и сжиженных газов, а так же магистралях для их перекачки.
В качестве простейшего примера рассмотрим цилиндрический сосуд известного радиуса, который мы будем обозначать за R. Пусть сосуд этот сделан из стали (прочность на разрыв порядка 100-150кгс⁄мм2, обозначим эту величину буковкой G). Давление в сосуде P=150 атмосфер. Спрашивается, какова должна быть толщина стенки сосуда (обозначим ее буквой d), чтобы от него не оторвало днище?
Пытаемся посчитать …;
Если днище круглое, то его площадь составляет S = πR2. Договоримся исчислять радиус в сантиметрах чтобы было удобнее, так как мы знаем, что 1атм - это давление, равное 1кгс⁄см2. Тогда совокупная сила, которая отрывает днище от стенки, есть
Что же может помешать оторвать днище? Только сталь, которой это днище крепится к корпусу (собственно это и есть сталь корпуса в районе днища). Предельное усилие, которое она может выдержать (при условии равномерного приложения нагрузки), зависит от толщины стенки, ее длины по окружности и прочности стали на разрыв. Ясно, что чем толще и длиннее (по сечению отрыва, т.е. по окружности) стенка, тем больше в ней тех самых мм2, каждый из которых выдерживает, будем говорить, 100кгс. Длина сечения отрыва составляет L = 2πR сантиметров, или 10 × 2πR = 20πR мм, а площадь 20πR × d мм2). Тогда предельное усилие, которое может выдержать сталь стенки на отрыв
Ясно, что максимальное усилие по отрыву днища не должно превышать предельно-допустимого, иными словами минимальная толщина стенки должна рассчитываться исходя из соображений Fпредел. = Fотрыв. Из этого условия следует, что
Принимаем значение G равным 100кгс/мм2. Кроме того, таким серьезным вещам, как 100 и более атмосфер приличествует по меньшей мере 4-5 кратный запас прочности. Тогда
Таким образом для баллона с радиусом 10см (это как раз стандартный 40 литровый баллон) минимальная толщина стенки должна быть
Хм… Видать, с запасом прочности переборщили - на деле она всего чуть больше сантиметра. Впрочем, важно не это. Пусть правильный коэффициент не 0,002, а, скажем, 0,001, имея ввиду хорошую сталь и более аккуратные расчеты (хотя для самоделок я рекомендовал бы все же 0,002!). Важно не это, а само соотношение:
Легко заметить, что потребная толщина стенки пропорциональна не только давлению (это как раз понятно), но и радиусу сосуда! Причем, замечу в скобках, не грузя лишними (и подчас сложными) расчетами, что это соотношение верно для любых (не очень извращенных) сосудов, только в качестве радиуса выступает любой характерный размер сосуда: для трубки - диаметр, для кубического сосуда - длина ребра и т.д. и т.п. Главное ясно понимать: если заменяешь в магистрали высокого давления одну трубку на другую, большего диаметра, убедись, что стенка у нее соответственно более толстая. Если заменяешь предохранительную мембрану на стационарной или транспортной емкости на самодельную (у нее, правда, противоположное назначение: в случае аварийного повышения давления вылететь первой, не дав разорваться всей емкости) - не останавливайся на той мысли, что жесть от консервной банки, которую ты на нее пустил, в двадцать раз тоньше, чем стенка бочки и, следовательно, все тип-топ. Диаметр-то у нее тоже в двадцать раз меньше, чем диаметр бочки! Неплохо бы выяснить, какая же там родная мембрана.
Кстати, о транспортной емкости … Если бы она работала в режиме баллона, то, сообразно нашим расчетам, толщина стенки у нее должна была бы быть около 20 сантиметров. Однако, на деле там и трех не наберется. Почему, спрашивается? Бочку с 20-сантиметровой стенкой ни одна машина с места не сдвинет, разве что танк. Поэтому транспортные емкости и не рассчитаны на полное давление углекислоты при комнатной температуре. Они предназначены только для перевозки и временного хранения сжиженной и весьма холодной (-70°С) углекислоты. Как только углекислота нагреется до более высокой температуры (а она обязательно рано или поздно нагреется, сколько ее не теплоизолируй) и давление поднимется выше 16атм, автоматически сработает предохранительный клапан, сбрасывая давление. После чего клапан надо тащить на переосвидетельствование, а емкость временно эксплуатируется со вторым (запасным) клапаном. Если после открывания клапан обмерзнет (а они имеют такую плохую привычку) и перестанет сбрасывать углекислоту, то в процессе дальнейшего нагрева углекислоты давление поднимется до 25-30 атмосфер, после чего вышибет предохранительную мембрану. В результате на переосвидетельствование придется тащить уже всю бочку, т.к. бочки со сработавшей мембраной к эксплуатации без переаттестации не допускаются. А если ты эту мембрану, к тому же, неправильно рассчитал и она не сработала - разорвет всю бочку, после чего придется тащить всех, при этом случившихся, в морг, а тебя - на кичу.
Впрочем, все это уже не предмет физики газов, которой, собственно, посвящено данное пособие.
6. О теплопередаче, теплоемкости и потерях при транспортировке, хранении и перекачке сжиженных газов
Я тешу себя мыслью, что соберусь с силами, и напишу данный раздел в будущем, так как он имеет самое непосредственное отношение к потерям, возникающим при работе наполнительных станций и, следовательно, к экономике всего газового хозяйства. Однако, на безопасность людей, в нем занятых, эта тема как будто не влияет (разве что на безопасность начальников, которым непременно достанется, если потери превысят допустимый уровень, а они будут что-то глупо бормотать про воздушный подогреватель, который, вишь ты, обмерзает в весенне-половодный период). Бог с ней, с экономикой, с ней разберемся по ходу пьесы, лишь бы все были живы и здоровы.
7. Заключение
а) Надо ясно отдавать себе отчет в том, что данное пособие далеко не полностью исчерпывает вопросы, и, в частности, вопросы безопасности при работе в газовом хозяйстве. Например, совершенно не затронуты вопросы химической активности многих веществ в нем используемых. А для таких сильных окислителей, как чистый кислород, или горючих газов, типа пропана, не говоря уже о такой загадочной и смертельно опасной штуке как ацетилен, именно они обуславливают добрую половину (а то и больше) проблем и неприятностей.
б) Формулы, приведенные в пособии, лишь приближенно описывают реальную действительность и для серьезных расчетов не годятся. Такие расчеты даже у профессионалов занимают не один месяц, но и тогда приходится проводить многочисленные натурные испытания, удаляя людей подальше от возможной зоны поражения. Даже применение их для оценки не всегда простая и благодарная задача в силу противоречивости данных справочников и, кроме того, широкого применения самых различных систем физических единиц (а перепутав милиджоули с мегакалориями легко ошибиться не просто в разы, а на 9 порядков), что само по себе требует высокой квалификации. Однако, это не значит, что знание этих формул в практической жизни бесполезно. В частности, пусть уравнение состояния идеального газа не удается применить потому, что сколько вы не откроете литературы - везде приводятся разные значения для универсальной газовой постоянной (кстати, вам только кажется, что они разные) - вы знаете из этого уравнения самое главное! Это главное состоит в том, что при повышении температуры давление растет, причем пропорционально росту температуры (а не квадрату или, скажем, кубу роста температуры), что при увеличении температуры вдвое (по шкале Кельвина, разумеется) вдвое вырастет и давление; что при увеличении объема газа давление падает обратно пропорционально росту объема и так далее. Все это позволяет вам, пусть не в точных цифрах, а качественно, на уровне больше-меньше, но предсказать результаты своих действий и не совершать хотя бы самых дурацких из них.
в) Любое, пусть самое лучшее, теоретическое знание вопроса никак не поможет человеку, слабо знающему матчасть. Свою установку надо знать не просто хорошо - досконально. До винтика, до последнего контакта реле. Что толку, что ты знаешь, что избыточное давление в транспортной емкости при его повышении выше критической величины надо сбросить, открыв вентиль газосброса, если ты не знаешь, где этот вентиль находится? Все подряд будешь открывать? Так ты дооткрываешься…
г) Никакие теоретические знания не заменят живой практики, однако и практика не заменит теорию. В любой работе, пусть редко, но встречаются нештатные ситуации, ранее не происходившие. Действия в этих ситуациях наугад, без понимания сути дела весьма чреваты! Баллоны закачиваются каждый день - это практика, а умирают лишь однажды. И не надо торопиться. Хорош не тот водитель, который каждый день худо-бедно доезжает до работы, а тот, который, пусть в ситуации, возникшей раз в жизни, найдет и реализует единственно верное решение. Иначе - БУМ! И все… Тут надо знать и про особенности поведения машины в заносе, и про ступенчатое торможение, и про скорость реакции, и про особенности психики других участников дорожного движения. Никакое знание нелишне.
д) В настоящее руководство несомненно вкрались фактографические и идеологические ошибки, в особенности в части вещей, которые пришлось изучать на скорую руку, в цейтноте, вызванном острой необходимостью написать хоть какое-то пособие. Я могу лишь надеяться, что ошибки эти не слишком велики. Про орфографические я уж и не заикаюсь.
Блинов А.Г.